Materi Virus
Posted by : Wahyu Dimas
Minggu, 06 Januari 2019
Perhatikan beberapa senyawa berikut!
Pembahasan
Untuk dapat mengerjakan soal tersebut, yang harus kita lakukan adalah
- Menuliskan struktur Lewis senyawa yang bersangkutan
- Menentukan jumlah pasangan elektron di sekitar atom pusat (PE)
- Menentukan jumlah pasangan elektron ikatan (PEI)
- Menentukan jumlah pasangan elektron bebas (PEB)
- Selanjutnya tinggal menentukan rumus bentuk molekulnya
Itu artinya, C memiliki 4 elektron
valensi dan O memiliki 6 elektron valensi. Langkah selanjutnya, yaitu
menentukan Struktur lewis dari senyawa CO2. Struktur lewisnya adalah
Dari struktur  itu diperoleh
itu diperoleh
- Jumlah pasangan elektron di sekitar atom pusat (PE) = 2
- Jumlah pasangan elektron ikatan (PEI) = 2
- Jumlah pasangan elektron bebas (PEB) = 0
Rumus yang diperoleh adalah AX2, AX2 merupakan bentuk molekul linear
Jadi, bentuk molekul CO2 adalah linear.
Itu artinya, Be memiliki 2 elektron
valensi dan Cl memiliki 7 elektron valensi. Langkah selanjutnya, yaitu
menentukan Struktur lewis dari senyawa BeCl2. Struktur lewisnya adalah Dari struktur
Dari struktur  itu diperoleh
itu diperoleh
 Dari struktur
Dari struktur - Jumlah pasangan elektron di sekitar atom pusat (PE) = 2
- Jumlah pasangan elektron ikatan (PEI) = 2
- Jumlah pasangan elektron bebas (PEB) = 0
Rumus yang diperoleh adalah AX2, AX2 merupakan bentuk molekul linear
Jadi, bentuk molekul BeCl2 adalah linear.
Itu artinya, P memiliki 5 elektron
valensi dan Cl memiliki 7 elektron valensi. Langkah selanjutnya, yaitu
menentukan Struktur lewis dari senyawa PCl3. Struktur lewisnya adalah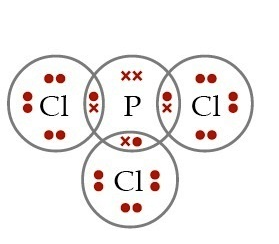

Dari struktur PCl3 itu diperoleh
- Jumlah pasangan elektron di sekitar atom pusat (PE) = 4
- Jumlah pasangan elektron ikatan (PEI) = 3
- Jumlah pasangan elektron bebas (PEB) = 1
Rumus yang diperoleh adalah AX3E, AX3E merupakan bentuk molekul piramida trigonal
Jadi, bentuk molekul PCl3 adalah piramida trigonal.
Itu artinya, N memiliki 3 elektron
valensi dan H memiliki 1 elektron valensi. Langkah selanjutnya, yaitu
menentukan Struktur lewis dari senyawa NH3. Struktur lewisnya adalah
Dari struktur NH3 itu diperoleh
- Jumlah pasangan elektron di sekitar atom pusat (PE) = 4
- Jumlah pasangan elektron ikatan (PEI) = 3
- Jumlah pasangan elektron bebas (PEB) = 1
Rumus yang diperoleh adalah AX3E, AX3E merupakan bentuk molekul piramida trigonal
Jadi, bentuk molekul NH3 adalah piramida trigonal.
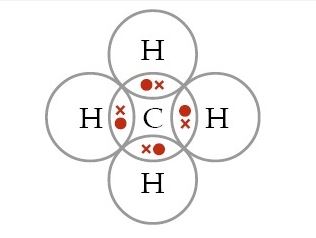
Itu artinya, C memiliki 4 elektron
valensi dan H memiliki 1 elektron valensi. Langkah selanjutnya, yaitu
menentukan Struktur lewis dari senyawa CH4. Struktur lewisnya adalah
Dari struktur CH4 itu diperoleh
- Jumlah pasangan elektron di sekitar atom pusat (PE) = 4
- Jumlah pasangan elektron ikatan (PEI) = 4
- Jumlah pasangan elektron bebas (PEB) = 0
Rumus yang diperoleh adalah AX4, AX4 merupakan bentuk molekul tetrahedron
Jadi, bentuk molekul CH4 adalah tetrahedron.
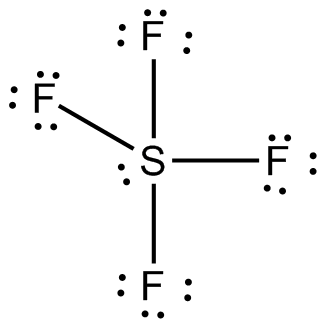
Itu artinya, S memiliki 6 elektron
valensi dan F memiliki 7 elektron valensi. Langkah selanjutnya, yaitu
menentukan Struktur lewis dari senyawa SF4. Struktur lewisnya adalah
Dari struktur SF4 itu diperoleh
- Jumlah pasangan elektron di sekitar atom pusat (PE) = 5
- Jumlah pasangan elektron ikatan (PEI) = 4
- Jumlah pasangan elektron bebas (PEB) = 1
Rumus yang diperoleh adalah AX4E, AX4E merupakan bentuk molekul tetrahedral terdistorsi
Jadi, bentuk molekul SF4 adalah tetrahedral terdistorsi.
Itu artinya, Br memiliki 7 elektron
valensi dan F memiliki 7 elektron valensi. Langkah selanjutnya, yaitu
menentukan Struktur lewis dari senyawa BrF5. Struktur lewisnya adalah
Dari struktur BrF5 itu diperoleh
- Jumlah pasangan elektron di sekitar atom pusat (PE) = 6
- Jumlah pasangan elektron ikatan (PEI) = 5
- Jumlah pasangan elektron bebas (PEB) = 1
Rumus yang diperoleh adalah AX5E, AX5E merupakan bentuk molekul tetragonal piramida
Jadi, bentuk molekul BrF5 adalah tetragonal piramida.
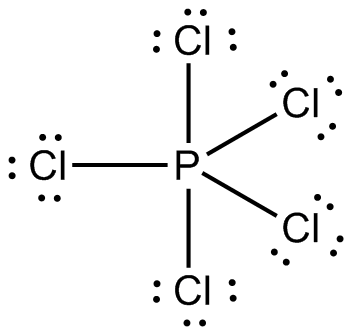
Itu artinya, P memiliki 5 elektron
valensi dan Cl memiliki 7 elektron valensi. Langkah selanjutnya, yaitu
menentukan Struktur lewis dari senyawa PCl5. Struktur lewisnya adalah
Dari struktur PCl5 itu diperoleh
- Jumlah pasangan elektron di sekitar atom pusat (PE) = 5
- Jumlah pasangan elektron ikatan (PEI) = 5
- Jumlah pasangan elektron bebas (PEB) = 0
Rumus yang diperoleh adalah AX5, AX5 merupakan bentuk molekul trigonal bipiramida
Jadi, bentuk molekul PCl5 adalah trigonal bipiramida.
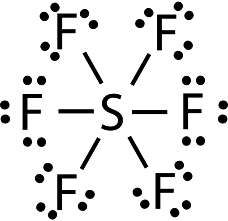
Itu artinya, S memiliki 6 elektron
valensi dan F memiliki 7 elektron valensi. Langkah selanjutnya, yaitu
menentukan Struktur lewis dari senyawa SF6. Struktur lewisnya adalah
Dari struktur SF6 itu diperoleh
- Jumlah pasangan elektron di sekitar atom pusat (PE) = 6
- Jumlah pasangan elektron ikatan (PEI) = 6
- Jumlah pasangan elektron bebas (PEB) = 0
Rumus yang diperoleh adalah AX6, AX6 merupakan bentuk molekul oktahedron
Jadi, bentuk molekul SF6 adalah oktahedron.