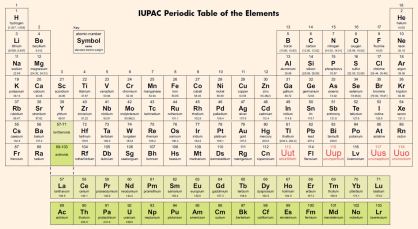
sistem periodik unsur adalah susunan unsur-unsur kimia berdasarkan urutan nomor atom dan kemiripan sifat.
Awalnya unsur -unsur dikelompokkan berdasarkan kemiripan sifat. selanjutnya, penggelompokkan didasarkan atas kenaikan massa atom dan kemiripan sifat.hal ini membawa pada penggelompokkan unsur unsur dalam suatu sistem periodik. pemahaman yang lebih baik tentang struktur atom membawa kita pada penggelompokkan unsur yang digunakan sekarang yakni sistem periodik modern.penggelompokkan ini didasarkan pada kenaikan nomor atom dan kemiripan sifat.
Sejarah Perkembangan Sistem Periodik

pengelompokkan unsu-unsur berdasarkan kenaikan nomor massa dan kemiripan sifat dimulai dari Triad Dobreiner, diikuti hukum Oktaf Newlands, sistem periodik Meyer, sistem periodik Mandeleev sampai sistem periodik Modern.
- Triad Dobreiner
ditahun 1829, Johann Dobreiner mengelompokkan unsur-unsur berdasarkan kemiripan sifat. tiap kelompok beranggotakan tiga unsur, sehingga disebut Triad. didalan Triad, unsur ke-2 mempunyai sifat yang berada diantara unsur ke-2 dan ke-3.
Dari pengelompokan unsur-unsur tersebut, terdapat suatu keteraturan. Setiap tiga unsur yang sifatnya mirip, massa atom (Ar) unsur yang kedua (tengah) merupakan massa atom rata-rata dari massa atom unsur yang pertama dan ketiga.

Sistem triad ini memiliki kelemahan yaitu kurang efisien karena ada beberapa unsur lain yang tidak termasuk dalam satu triad tetapi mempunyai sifat-sifat mirip dengan triade tersebut.
2. Teori Oktaf Newland
John Alexander, pada tahun 1864mengelompokkan unsur-unsur bedasarkan kenaikan massa atom. dari sifat-sifat unsurnya, ia mengamati adanya pengulangan sifat atau keperiodikan sifat unsur. Susunan Newland menunjukkan bahwa jika unsur-unsur disusun berdasarkan kenaikan massa atomnya, maka unsur pertama (unsur H) punya kemiripan sifat dengan unsur kedelapan (F), unsur kedua (unsur Li) dengan unsur kesembilan (unsur Na), dan seterusnya. oleh karen aitu terjadi pengulangan sifat setiap unsur ke-8 maka Penemuan Newland ini dinyatakan sebagai Hukum Oktaf Newland.
Pada saat daftar Oktaf Newland ini disusun, unsur-unsur gas mulia (He, Ne, Ar, Kr, Xe, dan Rn) belum ditemukan. Gas mulia ditemukan oleh Rayleigh dan Ramsay pada tahun 1984. Unsur gas mulia yang pertama ditemukan adalah gas argon.
Hukum oktaf ini memiliki kelemahan karena hanya berlaku untuk unsur-unsur ringan. Jika diteruskan, ternyata kemiripan sifatnya terlalu dipaksakan. Misalkan, Zn mempunyai sifat yang cukup berbeda dengan Be, Mg, dan Ca.
ternyata pengulangan sifat unsur tidak selalu terjadi pada unsur ke-8. hal ini ditunjukkan oleh Lothar Meyer.
3. Sistem Periodik Lothar Meyer
Ditahun 1864, lothar mayer melekukan pengamatan hubungan antara kenaikan massa atom dengan sifat unsur. hal ini dilakukan dengan membuat grafik massa atom versus volum atom pada gambar berikut :

dari kurva tersebut, ia melihat keteratutaran dari unsur-unsur dengan sifat yang mirip. sebagai contoh, litium (Li), Natrium (Na), Kalium (K), dan Rubidium (Rb) berada dititik puncak. dan ia juga mengamati bahwa jumlah unsur antara puncak-puncak tersebut berbeda. sebgai contoh, jumlah unsur dari puncak Li ke puncak Na adalah 8, demikian pula dari puncak Na ke puncak K. Namun dari puncak K ke puncak Rb dan dari puncak Rb ke puncak Cs lebih dari 8. dengan kata lain pengulangan sifat unsur tidak selalu terjadi setelah 8 unsur seperi dinyatakan dalam hukum oktaf.
ditahun 1868, Meyer menyusun unsur-unsur tersebut tersebut kedalam satu tabel berdasarkan kanaikan massa atom secara vertikel memebentuk kolom. penyusunan pada kolom akan berhenti dan berganti pada kolom berikutnya jika terjadi pengulangan sifat unsur. unsur-unsur dengan sifat yang mirip akan membentuk baris. penyusunan tersebut menghasilkan pengulangan/keperiodikan sifat fisis dan kimia unsur. oleh karenanya, tabel ini disebut tabel periodik atau sistem periodik. akan tetapi, Meyer baru mempublikasikan sistem periodiknya ditahun 1870 setelah sistem periodik mandeleev keluar.
4.Sistem Periodik Mendeleev

Dmitri Ivanovich Mendeleev pada tahun 1869, membuat mengelompokkan unsur-unsur berdasrakan kenaikan massa atom. jika unsur-unsur disusun menurut kenaikan massa atom relatifnya, maka sifat tertentu akan berulang secara periodik. Mendeleev menempatkan unsur-unsur yang mempunyai kemiripan sifat dalam satu lajur vertikal, yang disebut golongan. Lajur-lajur horizontal, yaitu lajur unsur-unsur berdasarkan kenaikan massa atom relatifnya, disebut periode.

keunggulan sistem periodik Mandeleev adalah sebagai berikut :
- sistem periodik mandeleev menyediakan beberapa tempat kosong untuk unsur-unsur belum ditemukan. sifat unsur-unsur tersebut dapat diramalkan berdasarkan kemirpan sifat unsur-unsur dalam satu golongan yang sama.
- sistem periodik mandeleev menyajikan data masaa atom yang lebih akurat dari beberapa unsur, sepertu unsur berilium (Be) dan Uranium (U)
- periode 4 dan 5 pada sistem periodik mandeleev tidak berbeda jauh dari sistem periodik modern. ada 2 unsur dalam setiap tempat pada kedua periode tersebut. sebagai contoh kalium (K) dan unsur tembaga (Cu), sama-sama berada pada golongan I diperiode ke 4.
- penempatan unsur-unsur gas mulia (He,Ne,Ar,Kr,Xe,Rn) yang ditemukan antara tahun 1890-1900, dalam sistem periodik mandeleev tidak menyebabkan perubahan susunan sistem tersebut.
Kekurangan sistem periodik Mendeleev:
- Panjang periode tidak sama dan sebabnya tidak bisa dijelaskan
- Beberapa unsur tidak disusun berdasarkan kenaikan massa atomnya, misalnya Te (128) sebelum I (127).
- Selisih massa unsur yang berurutan tidak selalu 2, tetapi berkisar antara 1 dan 4 sehingga sukar meramalkan massa unsur yang belum diketahui secara tepat
- Valensi unsur yang lebih dari saru sulit diramalkan dari golongannya
- Anomali (penyimpangan) unsur hidrogen dari unsur lain tidak dijelaskan.
5. Sistem Periodik Modern
dalam sistem periodik modern, unsur-unsur dikelompokkan berdasarkan kenaikan nomor atom (Z) yang mirip untu setiap unsur. pengelompokkan ini ternyata sesuai dengan konfigurasi elektron dari atom unsur.

dari sistem periodik modern, tampak bahwa penyusunan unsur-unsur berdasarkan kenaikan nomor atom dan kemiripan sifat ,menghasilkan keteraturan sifat berupa periode (baris) dan kemiripan sifat berupa golongan (kolom). kemiripan sifat dari unsur-unsur dalam golongan yang sama, terkait dengan konfigurasi elektronnya. unsur-unsur tersebut ternyata mempunyai jumlah elektron valensi yang sama.

Golongan
Kolom-kolom vertikal dalam sistem periodik disebut golongan. Penempatan unsur dalam golongan berdasarkan kemiripan sifat. Sistem periodik modern terdiri atas 18 kolom vertikal. Ada dua cara penamaan golongan, yaitu:
- Sistem 8 golongan. Menurut cara ini, sistem periodik dibagi menjadi 8 golongan yang masing-masing terdiri atas golongan utama (golongan A) dan golongan tambahan (golongan B). Unsur-unsur golongan B disebut juga unsur transisi. Nomor golongan ditulis dengan angka Romawi. Golongan-golongan B terletak antara golongan IIA dan IIIA. Golongan VIIIB terdiri atas 3 kolom vertikal.
- Sistem 18 Golongan. Menurut cara ini, sistem periodik dibagi kedalam 18 golongan, yaitu golongan 1 sampai dengan 18, dimulai dari kolom paling kiri. Unsur-unsur transisi terletak pada golongan 3-12
Beberapa golongan unsur dalam sistem periodik mempunyai nama khusus, diantaranya:
- Golongan IA : logam alkali (kecuali hidrogen)
- Golongan IIA : logam alkali tanah
- Golongan VIIA : halogen
- Golongan VIIIA : gas mulia
Unsur transisi dan transisi dalam
- Unsur Transisi
Unsur-unsur yang terletak pada golongan-golongan B disebut unsur transisi atau unsur peralihan. Unsur-unsur tersebut merupakan peralihan dari golongan IIA ke golongan IIIA, yaitu unsur-unsur yang dialihkan hingga ditemukan unsur yang mempunyai kemiripan sifat dengan golongan IIIA
- Unsur transisi dalam
Dua baris unsur yang ditempatkan dibagian bawah Tabel Periodik disebut unsur transisi dalam, yaitu terdiri dari:
- Lantanida, yang beranggotakan nomor atom 57-70 (14 unsur). Ke-14 unsur ini mempunyai sifat yang mirip dengan lantanium (La), sehingga disebut lantanoid atau lantanida
- Aktinida, yang beranggotakan nomor atom 89-102 (14 unsur). Ke-14 unsur ini sangat mirip dengan aktinium, sehingga disebut aktinoida atau aktinida
Semua unsur transisi dalam sebenarnya menempati golongan IIIB, yaitu lantanida pada periode keenam dan aktinida pada periode ketujuh. Jadi, golongan IIIB periode keenam dan periode ke tujuh, masing-masing berisi 15 unsur.
sistem periodik juga membagi unsur-unsur kedalam kelompok logam,non logam, yang dipisahkan secara diagonal oleh semi logam (metaloid). jika diperhatikan sifat unsur berkurang dari kiri kekanan. demikian pula, meski tidak terlihat jelas , sifat logam dalam sistem periodik bertambah dari atas ke bawah. penomoran golongan A dan B adalah sistem yang umum digunakan.
Hubungan Konfigurasi Elektron dengan Sistem Periodik
hubungan konfigurasi elektron dengan letak unsur dalam sistem periodik modern adalah sebagai berikut :
- unsur-unsur yang dalam periode yang sama mempunyai jumlah kulit elektron yang sama, jumlah kulit dinyatakan sebagai bilangan kuantum n (n = 1,2,3,…)
nomor periode menyatakan jumlah kulit (bilangan kuantum n)
- unsur-unsur dalam golongan yang sama mempunyai jumlah elektron valensi (e.v) yang sama.
nomor golongan menyatakan jumlah elektron valensi (e.v)
Sifat-sifat Periodik Unsur
Sifat periodik adalah sifat yang berubah secara beraturan sesuai dengan kenaikan nomor atom, yaitu dari kiri ke kanan dalam satu periode, atau dari atas ke bawah dalam satu golongan.sifat unsur dibedakan menjadi :
- sifat atomik, yakni sifat yang berhubungan langsung dengan struktur atomnya. sifat ini mencakup : jari-jari atom, energi ionisasi,afinitas elektron, kelektronegatifan dan bilangan oksidasi.
- sifat bulk/fisis, yakni sifat yang tidak hanya ditentukan oleh struktur atomnya, tetapi juga bagaimana atom-atom unsur (atau molekul-molekul unsur) saling terikat. sifat ini mencakup : kerapatan, titik leleh dan perubahan kalor leleh, titik didih dan perubahan kalor penguapan, serta daya hantar listrik dan panas.
- sifat kimia / kereaktifan.
Jari-jari Atom
Jari-jari atom adalah jarak dari inti hingga kulit elektron terluar. Besar kecilnya jari-jari atom terutama ditentukan oleh dua faktor, yaitu jumlah kulit dan muatan inti.
- Untuk unsur-unsur segolongan, jari-jari atom bertambah dari atas kebawah. semakin banyak kulit atom, semakin besar jari-jarinya. hal ini dikarenakan meski muatan inti bertambah positif, namun jumlah kulit semakin banyak keadaan ini menyebabkan gaya tarik menarik inti terhadap elektron semakin lemah. akibatnya jari-jari atom bertambah besar.
- Untuk unsur-unsur seperiode, jari-jari atom berkurang dari kiri kekanan. semakin besar muatan inti, maka semakin kuat gaya tarik inti terhadap elektron, sehingga semakin kecil jari-jarinya

Energi Ionisasi
Energi Ionisasi adalah energi yang diperlukan untuk melepaskan elektron yang terikat paling lemah oleh suatu atom atau ion dalam wujud gas.
ada 3 faktor yang mempengaruhi besarnya energi ionisasi atom :
- jari jari atom, semakin bsar jari-jari atom, semakin kecil energi ionisasi.
- muatan positif, semakin besar muatan inti, semakin besar energi ionisasi.
- jumlah elektron dikulit dalam, semakin banyak jumlah elektron dikulit dalam, semakin kecil energi ionisasi. hal ini karenakan elektron dikulit dalam akan mengurangi gaya tarik-menarik inti terhadap elektron terluar.
Hubungan energi ionisasi dengan nomor atom.
- dalam satu golongan, dari atas ke bawah, energi ionisasi semakin kecil
- dalam satu periode, dari kiri ke kanan, energi ionisasi cenderung bertambah
Besar kecilnya energi ionisasi bergantung pada besar gaya tarik inti terhadap elektron kulit terluar, yaitu elektron yang akan dilepaskan. Semakin kuat gaya tarik inti, semakin besar energi ionisasi
- dalam satu golongan,energi ionisasi bertambah dari kiri kekanan. hal ini dikarenakan muatan inti bertambah positif, namun jari-jari atom bertambah besar. sehingga menyebabkan gaya tarik menarik inti terhadap elektron terluar semakin lemah. akibatnya, energi ionisasi semakin berkurang.
- dalam satu periode, energi ionisasi berkurang dari atas kebawah. hal ini dikarenakan muatan inti bertambah positif dan nilai jari-jari atom berkurang sehingga menyebabkan gaya tarik menarik inti terhadpa elektron terluar semakin kuat. akibatnya, energi ionisasi semakin bertambah.

Afinitas Elektron
Afinitas elektron (AE) adalah energi yang terlibat jika suatu atom atau ion dalam fase gas menerima satu elektron membentuk ion negatif (atom bermuatan negatif). energi yang terlibat berupa pelepasan energi (AE negatif) atau penyerapan energi (AE positif. pelepasan energi berarti ion negatif yang terbentuk akan memiiki energi lebih rendah sehingga bersifat lebih stabil. sebaliknya penyerapan energi berarti ion negatif yang terbentuk akan memiliki energi yang lebih tinggi sehingga kurang stabil.
- Dalam satu golongan dari atas ke bawah, afinitas elektron cenderung berkurang. hal ini dikarenakan meski muatan inti bertambah positif, namun jumlah elektron kulit dalam semakin banyak. hal ini menyebabkan gaya tarik menarik inti terhadap elektron yang ditambahkan semakin lemah. akibatnya, afinitas elektron semakin berkurang.
- Dalam satu periode dari kiri ke kanan, afinitas elektron cenderung bertambah. hal ini dikarenakan meski muatan inti bertambah positif dan jari-jari atom berkurang. hal ini menyebabkan gaya tarik menarik inti terhadap elektron yang ditambahkan semakin kuat. akibatnya afinitas elektron semakin bertambah.
- Kecuali unsur alkali tanah dan gas mulia, semua unsur golongan utama mempunyai afinitas elektronn bertanda negatif. Afinitas elektron terbesar dimiliki oleh golongan halogen
Keelektronegatifan
Keelektronegatifan adalah suatu ukuran kemanpuan atom dalam menarik pasangan elektron yang digunakan bersama dalam membentuk ikatan.
Unsur yang mempunyai energi ionisasi dan afinitas elektron yang besar tentu akan mempunyai keelektronegatifan yang besar pula. semakin besar kelektronegatifan suatu atom, semakin besar kecendrungan untuk menarik elektron dari atom lain yang terikat secara kimiawi dengan atom tersebut.
- dalam satu periode, keelektronegatifan bertambah dari kiri kekanan. hal ini dikarenakan muatan inti bertambah positif dan jari-jari atom berkurang. kedaan ini menyebabkan gaya tarik menarik inti terhadap elektron semakin kuat. akibatnya, kemampuan atom untuk menarik elektron semakin besar.
- dalam satu golongan, keelektronegatifan berkurang dari atas kebawah. hal ini dikarenakan muatan inti bertambah positif. namun jumlah elektron dikulit dalam semakin banyak. akibatnya, jari-jari atom bertambah besar dan kemampuan inti untuk menarik elektron menjadi lemah.
Titik Leleh dan Titik Didih
titik leleh adalah suhu dimana tekanan uap zat padat sama denga tekanan uap zat cairnya. sedangkan titik didih adalah suhu dimana tekanan uap zat cair sama dengan tekanan disekitarnya.
- dalam satu periode, titik leleh dan titik didih awalnya meningkat dari kiri kekanan sampai golongan IVA lalu berkurang mencapai nilai rendah untuk golongan VIIIA.
- dalam satu golongan, titik leleh dan titik didih unsur logam berkurang dari atas kebawah. sedangkan titik leleh dan titik unsur non logam bertambah dari atas kebawah.
Sifat Logam dan Nonlogam
Sifat logam bergantung pada energi ionisasi. Semakin besar energi ionisasi, semakin sukar bagi atom untuk melepas elektron, dan semakin berkurang sifat logamnya.
Kereaktifan
Kereaktifan suatu unsur begantung pada kecenderungannya melepas atau menarik elektron. Dari kiri ke kanan dalam satu periode, mula-mula kereaktifan menurun kemudian bertambah hingga golongan VIIA.




